Cell Metab: 林东昕/郑健团队发现肥胖内脏脂肪组织通过激活肥大细胞促进胰腺癌免疫治疗耐受新机制
来源:BioArt 2025-12-04 11:18
本研究首次揭示了“内脏脂肪组织外囊泡-CTSA-假尿苷-肥大细胞”这一调控胰腺癌免疫逃逸的新分子轴,从全新角度系统阐明肥胖驱动肿瘤进展的核心机制,为开发针对肥胖相关胰腺癌的精准治疗策略奠定了理论基础。
已有文献报道,在多种实体瘤(如黑色素瘤、非小细胞肺癌等)中,肥胖患者往往表现出更好的免疫治疗反应,与肥胖是肿瘤发生的风险因素相矛盾,这一现象被称为“肥胖悖论”。
其潜在机制可能与肥胖状态下的代谢及免疫调节紊乱有关,例如肥胖选择性地诱导肿瘤相关巨噬细胞优先利用糖酵解上调PD-1 的表达,改善抗 PD-1 免疫治疗的反应。然而,在胰腺导管腺癌(PDAC)这一高度恶性、预后极差的肿瘤中,肥胖对免疫治疗反应的影响仍不明确,其机制待深入探索。
肥胖通常伴随内脏脂肪组织的异常积聚,而脂肪组织作为体内最大的内分泌器官,能够通过分泌多种生物活性因子,参与全身性代谢与免疫调节。除可溶性因子外,脂肪组织还可释放细胞外囊泡(EVs),作为不可溶性介质,在器官间的交流中发挥关键作用,调节受体器官的功能。
EVs能够携带蛋白质、脂质及核酸等生物分子,介导脂肪组织与肝脏、骨骼肌等外周组织的交流,参与非酒精性脂肪肝和糖尿病的进展。然而,脂肪来源的EVs是否能够介导脂肪组织与肿瘤组织之间的远程通讯,进而影响肿瘤微环境的免疫状态并导致免疫治疗抵抗,目前仍属未知。
2025年12月2日,中山大学肿瘤防治中心林东昕/郑健研究组在Cell Metabolism杂志发表题为Extracellular vesicles from obese visceral adipose promote pancreatic cancer development and resistance to immune checkpoint blockade therapy,首次发现EVs介导脂肪组织-肿瘤组织间通讯并促进胰腺癌免疫治疗耐受的发生。

本研究中,课题组首先利用脂肪移植来研究脂肪组织在胰腺癌进展中的作用。结果发现,正常小鼠在移植肥胖小鼠的脂肪组织后明显促进胰腺癌进展。进一步实验发现,肥胖脂肪组织分泌的外囊泡可明显加速胰腺癌进展,而去除外囊泡可显著减轻此效应。
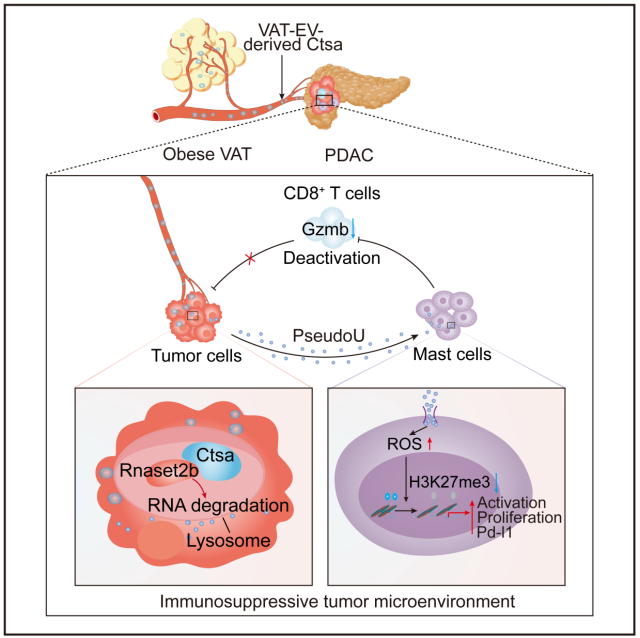
该研究发现了先前未知的脂肪组织-肿瘤组织间通信机制,其中来源于脂肪组织的EVs及其内容物CTSA能够以膜蛋白依赖的方式转移到肿瘤组织,并在肿瘤细胞中富集。CTSA可稳定肿瘤细胞溶酶体内的核糖核酸酶Rnaset2b,从而产生大量游离假尿苷(pseudouridine)。
这些假尿苷进一步激活肥大细胞,通过增加活性氧(ROS)水平并降低H3K27me3组蛋白修饰,促进基因表达。激活的肥大细胞抑制CD8⁺ T细胞功能,形成免疫抑制性肿瘤微环境,最终加速胰腺癌进展。
总之,本研究首次揭示了“内脏脂肪组织外囊泡-CTSA-假尿苷-肥大细胞”这一调控胰腺癌免疫逃逸的新分子轴,从全新角度系统阐明了肥胖驱动肿瘤进展的核心机制,为开发针对肥胖相关胰腺癌的精准治疗策略奠定了理论基础。
中山大学肿瘤防治中心特聘副研究员薛春玲、博士生赵思涵、博士生周一帆和博士后陈子明为本文共同第一作者。林东昕教授、郑健研究员和黄旭东副研究员为该研究论文的共同通讯作者。
原文链接:
https://www.cell.com/cell-metabolism/abstract/S1550-4131(25)00475-9
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


